Domácí pokusy z chemie |
 |
Pokus č.10 - Elektrolýza vody
Pomůcky:
- sklenice
- 2 železné hřebíky
- 2 vodiče: červený (+), modrý (-)
- baterie 9 V
- citronová šťáva nebo ocet
Postup:
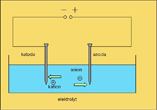
Do sklenice nalej vodu a přidej do ní několik kapek citronové šťávy nebo octa. (na 50 ml vody 10 kapek citronové šťávy). Dva očišťené odmaštěné železné hřebíky spoj pomocí vodičů s opačnými póly baterie o napětí 9 V. Hřebíky vsuň do vody tak, aby se vzájemně nedotýkaly. Použij destičku pěnového polystyrenu, do které vsuň hřebíky. Elektrolýzu nech probíhat 3 - 5 minut. Pozoruj, co se děje na jednotlivých hřebících (elektrodách).
Teorie:
Elektrolýza je děj, který probíhá na elektrodách při průchodu stejnosměrného elektrického proudu roztokem nebo taveninou. Aby tento děj mohl probíhat, musí být v roztoku nebo tavenině obsaženy volně pohyblivé ionty. Ke kladné elektrodě, anodě (+) směřují svůj pohyb záporně nabité ionty, anionty. K záporné elektrodě, katodě (-) jsou přitahovány kladně nabité ionty, kationty.
Otázka:
Na které elektrodě vzniká více plynu, na které méně? Na které elektrodě vzniká vodík, na které kyslík?
Vysvětlení:
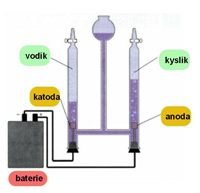
Na katodě se uvolňuje vodík H2, na anodě kyslík O2. Poměr vodíku a kyslíku je 2:1. Tuto skutečnost dokládá jiný pokus, a to rozklad vody H2O v Hofmanově přístroji (obr.5)
Rovnice:
2 H2O → 2 H2 + O2
Základní škola Letohrad, Komenského 269